Page 1 sur 3
Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 20:33
par Chris T°S
- Partie 1

- Partie 1
Bonsoir je viens ici afin d'obtenir de l'aide parce je n'y arrive pas ,voilà l'exercice en fichier joint .
voilà ce que j'ai fais :
1.)L'équation de la reaction de l'acide bbth+ avec l'eau est :BBTH+ + H2O = BBT + H3O+.
2.)L'expression de la constante d'acidité KA est Ka= [ BBT][H3O+] / [BBTH+].
3.) pas trouver
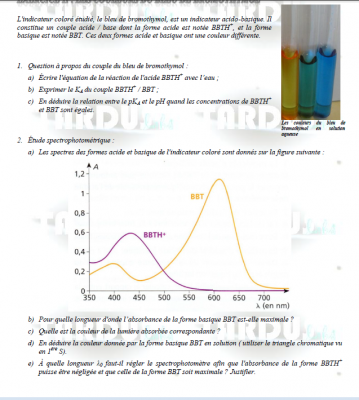
II b) et c) La forme BBTH+ presente une forme maximale vers 435 nm ce qui correspond a une teinte de bleu-violet.
b)L'appareil devra être régler a environ 610 nm afin que le l'apsorbtion du BBTH+ soit négliger (qui fait environ 435nm) et que celle de la forme BBT
soit maximale.
III.a)c = N/V+Vd donc C=3,0.10-711x10-3=2,7.10-5mol/l-1
Pour le reste je n'ai pas trouver
Si quelqu'un peut m'aider
Merci d'avance
Chris
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 21:04
par SoS(3)
Bonsoir Chris,
1a et 1b. TB
1.c repartez de la relation du Ka ; on vous dit que [BBTH+]=[ BBT] ; que pouvez-vous en déduire ?
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 21:16
par Chris T°S
La relation entre le pH et le pKa lorsque les concentration BBTH+ et BBT sont égales est :
pH = pKa + log [Ind-] /[HInd]
C'est ça j'ai vu ça dans le cours mais je comprend pas vraiment pourquoi du moins la démarche
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 21:22
par SoS(3)
Cela résulte du Ka : vous ne voyez pas le lien c'est cela : ou comment passer de l'expression de Ka à pKa ?
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 21:38
par Chris T°S
C'est ça ???
Ce que je comprend pas c'est le log enfaite parce que c'est une relation entre pK et pH mais je comprend pas pourquoi utiliser le log
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 21:51
par SoS(3)
alors en fait p signifie - log en chimie ; exemple pKa = - log Ka ; pH = - log [H3O+] ( avec [H3O+] divisée par 1 mol/L) ;
essayer maintenant en partant de l'expression de Ka que vous avez établie à pH = .... (il faut se servir de log (a.b) = log a + log b)
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 22:31
par Chris T°S
pH = pKA + log [BBT]
--------------
[BBTH+]
??
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : lun. 28 oct. 2013 22:47
par Chris T°S
Je trouve pas vraiment demain matin je me pencherais sur la question .
Merci et Bonne soirée
A demain
Chris
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : mar. 29 oct. 2013 10:12
par Chris T°S
Bonjour ,
pH=Pka+Log a/Log b ??
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : mar. 29 oct. 2013 10:59
par SoS(3)
J'attendais le développement du calcul : vous avez donc Ka = [ BBT][H3O+] / [BBTH+] soit [H3O+] = Ka .[BBTH+]/[ BBT] puis
-log [H3O+] = -log ka - log [BBTH+]/[ BBT] et on arrive donc en effet à l'expression que vous avez donnée donc ensuite que vaut pH pour
[ BBT] = [BBTH+] ?
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : mar. 29 oct. 2013 11:15
par Chris T°S
Lorsque [BBT] =[BTTH+] le ph vaut 7,2
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : mar. 29 oct. 2013 11:26
par SoS(3)
On vous demande juste la relation et non pas la valeur que vous allez déterminer dans la suite du problème ;
donc pH = pKa
2.b Vous avez fait une erreur la question porte sur BBT
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : mar. 29 oct. 2013 11:29
par Chris T°S
Merci
Pour le II)B) La forme BBT presente une forme maximale vers 610 nm ce qui correspond a une couleur jaune
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : mar. 29 oct. 2013 11:32
par SoS(3)
610 nm correspond plutôt à du rouge qui est absorbé.
Vous pouvez continuer.
Re: Réaction Acido-Basic,couple et mesure de pH
Posté : mar. 29 oct. 2013 11:38
par Chris T°S
A désoler je croyais que 750 nm était du rouge .
La couleur perçue est la couleur diamétralement opposée à la couleur absorbée sur le triangle chromatique : en solution
aqueuse, la forme basique du BBT est donc bleue