Page 1 sur 1
molécule
Posté : mer. 16 janv. 2013 00:40
par Hugo
Bonsoir
J'aimerais savoir pourquoi dans une représentation géométrique, les doublets non liants sont importants étant donné qu'ils responsables de la géométrie de la molécule, alors qu'ils n'interviennent pas dans la formation de la molécule (il n'y a pas mise en commun d'électron entre les différents éléments constituant la molécule) ??
Re: molécule
Posté : mer. 16 janv. 2013 07:39
par SoS(41)
Bonjour Hugo,
Les doublets d'électrons, qu'ils soient liant ou non liant portent des charges électriques négatives. Ces charges électriques se repoussent. La géométrie de la molécule se met en place suivant une règle très simple : les éléments qui se reposent doivent être le plus éloignés possible.
Vous pourrez en déduire les formes géométriques suivant le nombre de doublets portés par l'atome central.
N'hésitez pas à poursuivre vos questions, la plus grande qualité d'un scientifique est sa curiosité.
Sos(41)
Re: molécule
Posté : mer. 16 janv. 2013 21:15
par Hugo
A vrai ce n'est pas la géométrie des molécules qui me gène mais l'importance des doublets non-liants.
Je ne comprends pas très bien car j'aurais pensé que les doublets non-liants ne se repoussent pas étant donné qu'il n'y a pas mise en commun d'électron avec les autres éléments constituant la molécule contrairement aux doublets liants.
Re: molécule
Posté : mer. 16 janv. 2013 22:04
par SoS(41)
Bonjour Hugo,
Je ne vous expliquerai pas ici pourquoi les électrons s'associent en doublet dans un doublet non-liant. Par contre, les électrons portant tous des charges négatives, vous admettrez que les charges identiques se repoussent et donc que le doublet soit liant ( comme dans les liaisons covalentes) ou non-liant comme dans votre question, la règle de la répulsion s'applique.
en espérant que cette précision répond à votre question
Sos(41)
Re: molécule
Posté : mer. 16 janv. 2013 22:12
par Hugo
D'accord
Est-ce qu'au sein d'un atome les électrons présents dans son cortège électronique se repoussent ?
Re: molécule
Posté : mer. 16 janv. 2013 22:15
par SoS(41)
Bonjour Hugo,
Biensûr, l'effet est valable pour tout électron.
Re: molécule
Posté : mer. 16 janv. 2013 22:18
par Hugo
Est-ce que malgré ces répulsions le électrons restent sur une même couche électronique (K, L, M,...) ?
Re: molécule
Posté : mer. 16 janv. 2013 22:32
par SoS(41)
Bonjour Hugo,
N'oubliez pas que nous sommes dans des représentations simplifiées. Retenez que ces électrons sont bien sur les couches électroniques (K, L, M...) et que l'effet de répulsion s'applique, vous pourrez y associer un peu plus tard la compréhension des niveaux d'énergie et ainsi approfondir votre approche de l'atome. Un certain Schrodinger vous aidera dans votre démarche mais en 1S, on ne dispose pas encore des outils mathématiques nécessaires.
Poursuivez votre questionnement pour mieux comprendre les liens entre les atomes et la géométrie des molécules.
Re: molécule
Posté : mer. 16 janv. 2013 22:36
par Hugo
Nous avons étudiez les niveaux d'énergies mais je ne vois pas le lien entre les répulsions des électrons et les niveaux des énergies ?
Re: molécule
Posté : mer. 16 janv. 2013 22:39
par SoS(41)
Vous avez raison, retenez que la répulsion s'applique entre les électrons car ils portent des charges identiques même lorsqu'ils sont dans les couches internes.
Re: molécule
Posté : jeu. 17 janv. 2013 10:30
par Hugo
Concrètement qu'est-ce que c'est un doublet ?
Ce sont deux électrons mais je ne vois pas pourquoi on les regroupe par deux ? Ils se repoussent donc il ne peuvent pas être ensembles ?
Re: molécule
Posté : jeu. 17 janv. 2013 13:19
par SoS(41)
Bonjour Hugo,
Un doublet, c'est bien deux électrons mais vous remarquerez qu'il ne sont jamais ensemble au "même endroit". Le fait de se mettre par deux s'explique avec ce qu'on appelle la mécanique quantique. L'exemple le plus parlant est celui du doublet liant, c'est à dire de la liaison covalente : deux atomes échanges deux électrons (chacun un) mais les électrons ne sont jamais ensemble, ils vont simplement par paire d'où le nom de doublet.
Re: molécule
Posté : ven. 18 janv. 2013 02:41
par Hugo
Donc si j'ai bien compris
Les doublets sont juste une façon de concevoir les choses, en réalité ils n'existent pas c'est-à-dire que les électrons ne sont pas liés deux par deux ?
Re: molécule
Posté : ven. 18 janv. 2013 18:54
par SoS(38)
Bonsoir,
Tout modèle de physique ou chimie présente ses limites. Le modèle de Lewis utilise ces répartitions d'électrons et permet de justifier beaucoup de formules de molécules.
Vous verrez plus tard que d'autres modèles existent, en particulier pour les répartitions d'électrons sur les couches.
Re: molécule
Posté : ven. 18 janv. 2013 23:36
par SoS(38)
Bonsoir,
Il y a apparemment des problèmes avec les messages. Je réponds donc de mémoire.
La liaison entre les atomes est due à la mise en commun d'électrons. Seule la mécanique quantique, comme l'a dit mon collègue sos(41) peut expliquer les choses.
En réalité, on doit passer par la notion d'orbitale, ici des cercles centrés sur le noyau .
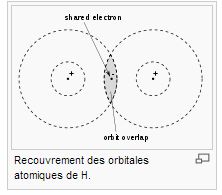
- orbitale.JPG (16.05 Kio) Vu 4840 fois
Les orbitales sont liées aux lieux où les électrons peuvent être présents. Il faut que ces orbitales se recouvrent suffisament pour assurer une liaison. Vous avez l'exemple de la molécule de dihydrogène.Dans ce cas, l'interaction entre orbitales donc entre électrons permet une liaison.On sort du modèle de répulsion entre charges de même signes uniquement pour les liaisons au coeur de la molécule.
Mais le modèle de répulsion électrique reste valable pour les lieux ou les électrons vont avoir le plus de probabilité de se situer. Les lieux ou les électrons forment les liaisons et où les électrons restent autour d'un atome sans lier vont déterminer la géométrie des liaisons.
La théorie des doublets non liants n'est qu'un modèle simplificateur mais permet de voir ces répulsions et la géométrie de la molécule et de savoir où sont les parties négatives d'une molécule.