Page 1 sur 1
Aluminium et Zinc
Posté : lun. 1 nov. 2010 13:16
par Lilou 1ere S
J'ai commencé à faire un exercice mais je me trouve complètement bloqué, quelqu'un pourrait-il m'aider ?
Je scan l'exercice

- Enoncé exercice 1
;
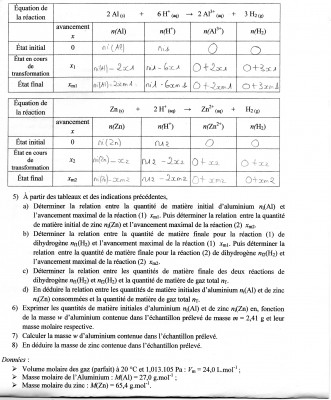
- Enoncé exercice 2
et ensuite je scan mon brouillon

- Brouillon 1)
. Je suis bloquée à partir de la question 5c).
[ 5b) : nf1 (H2) = 3xm1 --> 3 fois plus
c) PV = RnT d'où n = PV/RT
n = (1.013 x10^5x2.59x10^3)/(8.314x293.15) = 1.08 x10^-1 ]
Re: Aluminium et Zinc
Posté : lun. 1 nov. 2010 13:52
par SoS(14)
Bonjour Lilou,
Avant d'en venir à la question 5c), la réponse que vous proposez à la 5b) me "laisse sur ma faim"
Lilou 1ere S a écrit :[ 5b) : nf1 (H2) = 3xm1 --> 3 fois plus
que quoi ? que qui ?
Vous pourriez utiliser la réponse à la 5a) afin d'avoir un lien entre ce qu'on a mis au début et ce qu'on recueille à la fin ...
et pour nf2 (H2) ??
Pour la 5c) de quoi est constitué le dégagement gazeux de l'expérience ? d'où provient-il dans vos écritures de réaction ? à partir des réponses à ces deux petites questions, cela doit venir tout seul ...
Pour le début de l'exercice je suis d'accord avec vos réponses (dont certaines gagneraient à être un peu plus rédigées)
A bientôt
Sos(14)
Re: Aluminium et Zinc
Posté : mar. 2 nov. 2010 11:23
par Lilou 1ere S
Merci d'avoir répondu à ma demande d'aide.
Je ne vois pas comment je peux utiliser la question 5a) pour répondre à la b) car pour la a) on me parle de l'aluminium et du zinc et on me parle du dihydrogène pour la b). Et en réessayant de faire cette question b), je trouve qu'il y a 3/2 fois plus de H2 (à l'état final) que de Al (à l'état initial). Et il y a autant de H2 à la fin de la réaction que de Zn au début.
Pour la 5c), le dégagement gazeux est du H2. Il provient du H+ qu'il y a avait un début de la réaction.
Re: Aluminium et Zinc
Posté : mar. 2 nov. 2010 14:06
par SoS(14)
Bonjour Lilou,
Pour en revenir à la 5 a) disons que les dernières lignes de vos deux tableaux d'avancements ne sont pas tout à fait complètes (elles sont correctes, mais pourraient être encore plus précises compte tenu de ce que vous avez répondu à la 3 (sur les réactifs limitant de ces deux réactions).
Mais ce que vous m'écrivez :
Lilou 1ere S a écrit :Et en réessayant de faire cette question b), je trouve qu'il y a 3/2 fois plus de H2 (à l'état final) que de Al (à l'état initial). Et il y a autant de H2 à la fin de la réaction que de Zn au début.
me conforte dans l'idée que vous avez compris car
ces affirmations sont correctes.
Pour la 5c) c'est bien du H2 qui est produit ... et il vient bien de vos deux réactions :
- la première ayant produit n1(H2)
(qui vaut 3/2 n(Al), ça c'est pour la 5d) mol de dihydrogène
- et la seconde n2(H2)
(qui vaut n(Zn), ça c'est pour la 5d) mol de dihydrogène
Donc au total nT = ...... + ...... car le dihydrogène n'est produit QUE par ces deux réactions.
puis la 5d) s'enchaîne (compte tenu de ce que j'ai écris en
italique ci-dessus)
A tout de suite
Sos(14)
Re: Aluminium et Zinc
Posté : mar. 2 nov. 2010 16:49
par Lilou 1ere S
Je trouve : nT = nf1(H2) + nf2(H2)
donc nT = 3/2n(Al) + n(Zn)
6) ni(Al) = m/M donc ni(Al) = w/27.0
et ni(Zn) = m/M donc ni(Zn) = (2.41-w)/65.4
Et je me trouve encore bloquée pour la 7, car je voie aucune donnée qui peut m'aider à trouver w.
8) m(Zn) = 2.41 - w
Re: Aluminium et Zinc
Posté : mar. 2 nov. 2010 17:00
par SoS(14)
Bonjour Lilou,
Ce que vous notez ni(Al) ne correspond-il pas à n(Al) de la réponse précédente ?
Et de même pour ni(Zn) ?
Or vous savez que
Lilou 1ere S a écrit :nT = 3/2n(Al) + n(Zn)
Or sur votre brouillon vous avez répondu à la question 2 ... donc vous connaissez nT
Vous avez une inconnue "w" et une relation nT = 3/2n(Al) + n(Zn) (à exprimer en fonction de w) c'est gagné !
Sos(14)
Re: Aluminium et Zinc
Posté : mar. 2 nov. 2010 17:16
par Lilou 1ere S
Ni(al) = n(Al) et ni(Zn) = n(Zn).
nY = 1.08 x 10^-1
nT = 3/2n(Al) = n(Zn) donc 1.08 x10^-1 = 3/2 x (w/27.0) + (2.41-w)/65.4
= 3/2w/27.0 + (2.41 - x)/65.4
Je voie toujours pas comment trouver w...
Re: Aluminium et Zinc
Posté : mar. 2 nov. 2010 17:22
par SoS(14)
Bonjour Lilou,
Vous allez un peu trop vite d'où des erreurs qui apparaissent dans votre écriture alors même que votre raisonnement est bon ... moralité : allez plus doucement ...
Je reprends votre message et le corrige en gras
Lilou 1ere S a écrit :Ni(al) = n(Al) et ni(Zn) = n(Zn). là OK
nY = 1.08 x 10^-1 mol je présume ?? et nY = nT ??
nT = 3/2n(Al) = n(Zn) donc 1.08 x10^-1 = 3/2 x (w/27.0) + (2.41-w)/65.4
= 3/2w/27.0 + (2.41 - w)/65.4 C'est w qui intervient et non "x"
Ensuite il n' y a plus qu'à développer 1,08.10-1 = (1.5/27) * w + (2.41/64) - (1/64)*w ... puis achever le calcul(on isole w) afin de répondre aux dernières questions ...
Sos (14)
Re: Aluminium et Zinc
Posté : mar. 2 nov. 2010 19:06
par Lilou 1ère S
nY = nT (faute de frappe !)
nT= 3/2n(Al) + n(Zn) avec nT = 1.08 x10^-1 mol
nT = 3/2 * (w/27.0) + (2.41-w)/65.4
1,08.10-1 = (1.5/27) * w + (2.41/65.4) - (1/65.4)*w
(1.08*10^-1)-(2.41/65.4) = (1.5/27)*w -(1/65.4)*w
= w((1.5/27)-(1/65.4))
D'où w= (1.08*10^-1-(2.41/65.4))/((1.5/27)-(1/65.4))
w= 1.08*10^-1-(2.1/65.4)*(1/(1.5/27)-(1/65.4)
w= 1.08*10^-1-(2.1/65.4)*((27/1.5)-(65.4/1))
w=1.6g
Donc m(Zn) = 2.41 - w
= 2.41 -1.6
= 0.81g.
Il y donc 1.6 d'aluminium et 0.81g de Zinc dans l'échantillon prélevé.
PS : Votre valeur 64 dans le calcul proposé est une faute de frappe (65.4) ?
Re: Aluminium et Zinc
Posté : mer. 3 nov. 2010 10:16
par SoS(14)
Bonjour Lilou,
Je trouve w = 1,77 g et non 1,6 g ...erreur de calcul ... peut être ici lorsque le 2,41 devient 2,1 à la ligne en dessous ...
Lilou 1ère S a écrit :D'où w= (1.08*10^-1-(2.41/65.4))/((1.5/27)-(1/65.4))
w= 1.08*10^-1-(2.1/65.4)*(1/(1.5/27)-(1/65.4)
sinon vous avez compris ! C'est du bon travail !
Attention tout de même aux chiffres significatifs ! il y en a trois dans toutes les données de l'énoncé (2,41 g ; 2,59 L ; 24,0 L/mol ; 27,0 g/mol et 65,4 g/mol) donc vos résultats devraient eux aussi avoir trois chiffres significatifs.
Et oui j'avais fait une faute de frappe le 65,4 s'étant transformé en 64.
Si vous n'avez plus de question sur ce sujet, puis-je le clore ?
N'hésitez pas à revenir
Sos(14)
Re: Aluminium et Zinc
Posté : mer. 3 nov. 2010 17:56
par Lilou 1ere S
Merci beaucoup. Et au prochain problème de compréhension en PC je reviendrai sur ce super forum sans hésiter !
Re: Aluminium et Zinc
Posté : mer. 3 nov. 2010 19:23
par SoS(14)
Ce fut avec grand plaisir que nous vous avons aidé et que nous vous aiderons la prochaine fois, n'hésitez jamais.
sos(14)